¿Qué es la materia?
La materia es todo lo aquello que posee masa, ocupa un lugar en el espacio y además es cuantificable, esto quiere decir que se puede medir.
La materia se clasifica en cuatro estados que son:
Líquido: Las partículas que los forman se encuentran poco ordenas, las fuerzas de atracción entre las partículas es media, por esto no tienen forma propia y se adaptan al recipiente que los contienen, su volumen depende de su recipiente (v= fx= envase), son incompresibles y fluyen.
Gaseoso: Las partículas que los forman se encuentran altamente dispersadas, las fuerzas de atracción son casi nulas, no poseen forma propia, por lo tanto, se adapta al recipiente que lo contiene, el movimiento de sus partículas es muy alto, en línea recta y aleatoria, son compresibles, fluyen y difunden (esparcen).
Plasma: este estado se forma a través de la ionización de átomos por lo tanto sus partículas se encuentran ionizadas (perdió un electrón o un protón), se encuentra en el sol de manera natural, y se produce bajo gran presión y temperatura, ya que bajo estas condiciones los electrones del agua se sueltan quedando sobre esta y así se forma el ESTADO DE PLASMA.
Sólidos: Las partículas que los forman se encuentran en un orden espacial, ocupando posiciones fijas, esto le da un orden interno cristalino ya que las fuerzas entre sus partículas son muy fuertes, además poseen forma y volumen propio, son incompresibles, las fuerzas predominantes son las de atracción y la difusión es prácticamente nula (no se esparcen).
Si las partículas que forman a los sólidos son átomos, estos se encuentran unidos por enlaces covalentes muy fuertes y por lo tanto deben tener una posición fija ya que de lo contrario el enlace se rompe, estos sólidos son bastante duros (entendiendo por dureza la capacidad que posee un sólido para rayar a otro), frágiles y sus puntos de ebullición y fusión son bastante altos, ejemplo de este tipo de solido es el diamante.
Si las partículas por las cuales se encuentra formado son moléculas, se encuentran unidas por las fuerzas de Van der Waals (fuerzas bastante débiles), estos sólidos son blandos, y sus puntos de fusión y ebullición son bajos, ejemplo de este tipo es el azúcar.
Y por ultimo si sus partículas son iones puede tratarse de metales, que se encuentran formados por iones positivos que se encuentran rodeados de electrones, los cuales son buenos conductores de electricidad, son duros y sus puntos de fusión y ebullición son muy elevados, ejemplo de esto son el oro y la plata, o de compuestos iónicos, los cuales debido a su fuerte atracción electrostática entre los iones opuestos, son duros, frágiles y no conducen corriente eléctrica a menos que se encuentren diluidos como ser FeO (oxido de hierro II) o MnO2 (manganeso)
Criterios de clasificación de los sólidos
Según la distribución en el espacio de los átomos que poseen los sólidos estos los podemos clasificar en:
Sólidos Amorfos: están formados por átomos, moléculas o iones que no poseen orden definido (presentan un orden de corto alcance, las posiciones ocupadas no se repiten para largas distancias atómicas), su estructura interna es más parecida a la de un liquido que a la de un sólido, ya que su estructura microscópica interna no es regular, por lo tanto los sólidos amorfos vendrían siendo sólidos falsos, esto quiere decir que se comportan como sólidos pero no lo son, un ejemplo de esto es el vidrio .  |
| Estructura de un solido amorfo |
 |
Ejemplo de un solido amorfo |
Sólidos cristalinos: estos al igual que los sólidos amorfos se encuentran formados por átomos, moléculas o iones, los cuales se encuentran en posiciones definidas y en un orden tridimensional (su celda unitaria se repite), son sólidos verdaderos como la madera o el diamante.
 |
| Estructura interna del diamante, ejemplo de un solido cristalino |
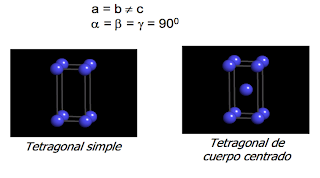
¿Qué es la celda unitaria?
Una celda unitaria la cual es un paralelepípedo que está formada por el menor grupo de átomos que se repite dando forma todo el cristal, la cual se caracteriza por tener tres vectores de traslación, vector “Y” que nos señala el alto, vector “X” que es el que nos señala el largo y el vector “Z” el cual nos señala el ancho o la profundidad y seis parámetros que son: la longitud de los lados y la medida de sus ángulos los cuales se conocen como parámetros de red.
Según las celdas unitarias de los solidos cristalinos, Auguste Bravais reconoce 14 sistemas cristalográficos de los cuales propone siete que son diferentes entre si, estos son: